北京时间2019年10月31日凌晨,复旦大学信息科学与工程学院光科学与工程系费义艳与复旦大学生命科学学院鲁伯埙和丁澦合作,以“HTT-LC3连接化合物对变异HTT蛋白的等位基因选择性降低”(“Allele-selective Lowering of Mutant HTT Protein by HTT-LC3 Linker Compounds”)为题,在《Nature》主刊上发表文章(article),介绍了该团队基于自噬小体绑定化合物(ATTEC)的药物研发原创新概念,巧妙地通过基于化合物芯片和前沿光学方法的筛选,发现了特异性降低亨廷顿病致病蛋白的小分子化合物,有望为亨廷顿病的临床治疗带来新曙光。复旦大学鲁伯埙、费义艳和丁澦为该论文通讯作者,复旦大学博士生李朝阳、王岑、王紫英和朱成钢为第一作者。相关工作得到了国家自然科学基金委以及国家科技部等多个项目的资助。

费义艳和她的研究生朱成钢
费义艳课题组发展了一套高通量、无标记测量生物分子相互作用的光学平台,在蛋白质、小分子、病毒、细菌等各类生物体系中开展了广泛的研究。该平台由生物芯片和斜入射光反射差(Oblique-Incidence Reflectivity Difference, OI-RD )扫描光学显微技术组成。生物芯片将成千上万种生物分子规则地固定在固体基片上,根据固定分子种类的不同,可以分为DNA芯片、蛋白芯片、小分子芯片等。课题组发展了能够制备高质量生物芯片的方法和免标记检测生物芯片的OI-RD光学系统。OI-RD系统能够灵敏地检测生物芯片上微小的厚度或折射率变化,从而实现生物分子间相互作用的无标记测量。通过二维扫描,OI-RD系统能够对8~10 cm2的生物芯片进行成像,因此具备同时测量上万个生物分子间相互作用的高通量检测能力。该系统为大规模研究生物分子相互作用提供了高效的研究工具。
费义艳课题组与复旦大学生命科学学院鲁伯埙和丁澦课题组通力合作,利用小分子芯片和OI-RD系统,发现了特异性降低亨廷顿病致病蛋白的小分子化合物。亨廷顿病是四大神经退行性疾病之一,由于引起该病的变异亨廷顿蛋白(mHTT)生化活性未知,无法被传统的小分子化合物阻断或抑制,因此降低mHTT蛋白水平是治疗亨廷顿病的极具前景的治疗方法。自噬是细胞内降解蛋白的一种重要途径,能够降解所有包裹进自噬小体的蛋白,功能强大,但是缺乏选择性。如何特异性地降低mHTT蛋白水平,而不影响其它蛋白,特别是不影响与mHTT高度相似的且具有神经保护功能的野生型亨廷顿蛋白(HTT),是领域内长期以来的一大难题。因为自噬小体上存在标志性蛋白LC3,鲁伯埙教授原创性地提出一种基于自噬小体绑定化合物ATTEC (Autophagosome Tethering Compounds)的药物研发新概念。ATTEC也可以称为“小分子胶水”,它可以特异性结合LC3及致病蛋白,进而将致病蛋白包裹进自噬小体进行降解。同时,“小分子胶水”并不结合正常蛋白,使其得以安然无恙。
事实上,此类“小分子胶水”并不好找,在庞大的小分子库中寻找几个可能的“小分子胶水”犹如大海捞针,这导致基于ATTEC的药物研发原创概念的实现搁置了若干年。费义艳课题组发展的高通量生物分子相互作用检测平台,为寻找“小分子胶水”提供了高效、经济的研究工具。课题组将近四千种小分子化合物点样于芯片上,当特定的小分子与丁澦课题组提供的靶标蛋白结合时,小分子厚度增加,这个变化能够被OI-RD方法精准检测。据此,合作团队共找到两种小分子,它们既能够与LC3蛋白结合,也能够与mHTT蛋白结合,但不与HTT蛋白结合。通过对具有类似结构的小分子化合物的检测,共获得四种可绑定LC3与mHTT蛋白的“小分子胶水”。
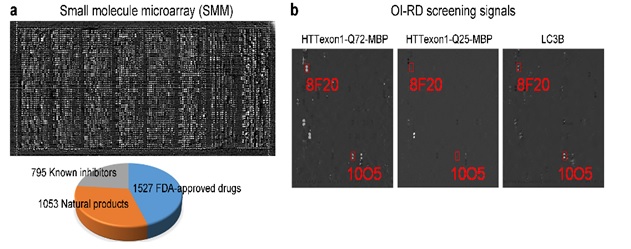
(a) 小分子芯片的OI-RD图像;(b)两种小分子能够特异性结合LC3和mHTT蛋白,但不结合HTT蛋白。
团队发现,这四种化合物在小鼠神经元、亨廷顿病病人细胞以及亨廷顿病果蝇模型中,均可显著降低mHTT蛋白水平,而几乎不影响HTT蛋白水平,且起效浓度~10 nM。此外,两种化合物可以跨过血脑屏障,低剂量腹腔给药也能够达到相同效果,同时也改善了疾病相关的表型。进一步,团队发现这些小分子化合物能够区分mHTT与HTT是因为它选择性地结合mHTT所特有的过长谷氨酰胺重复(polyQ)区域。依据这一特性,这些小分子化合物将有可能用于治疗目前已知的由于polyQ过长引起的九种疾病。团队在脊髓小脑共济失调III型病人细胞中获得了预期效果。神经退行性疾病领域著名科学家Huda Zoghbi(美国科学院院士、科学突破奖(breakthrough prizes)获得者)为该研究撰写了专文评论,发表于Nature,正面评价推荐了此项研究。
此外,基于高通量生物分子相互作用的光学测量平台,费义艳课题组与肺科医院刘海鹏研究员合作,在《Nature》主刊上也合作发表了重要研究成果(Nuclear cGAS suppresses DNA repair and promotes tumorigenesis)。该光学测量平台在生物医药等领域的应用将大放光彩。
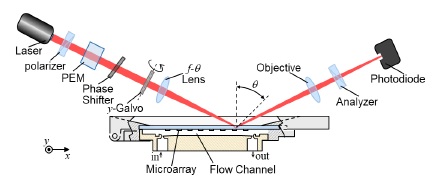
费义艳课题组开发的高通量生物分子相互作用的光学测量平台
相关文献:
1、与生科院合作的应用于药物筛选的文章:
https://www.nature.com/articles/s41586-019-1722-1
2、与肺科医院合作的Nature文章的链接:
https://www.nature.com/articles/s41586-018-0629-6
3、高通量生物小分子芯片制作的技术文章:
https://www.mdpi.com/1424-8220/16/3/378/htm
4、高通量生物分子相互作用的光学测量平台相关的文章;
https://aip.scitation.org/doi/abs/10.1063/1.2830286?journalCode=rsi

 复旦主页
复旦主页 实验室安全
实验室安全 复旦邮箱
复旦邮箱 办事大厅
办事大厅

